
onder een lamp
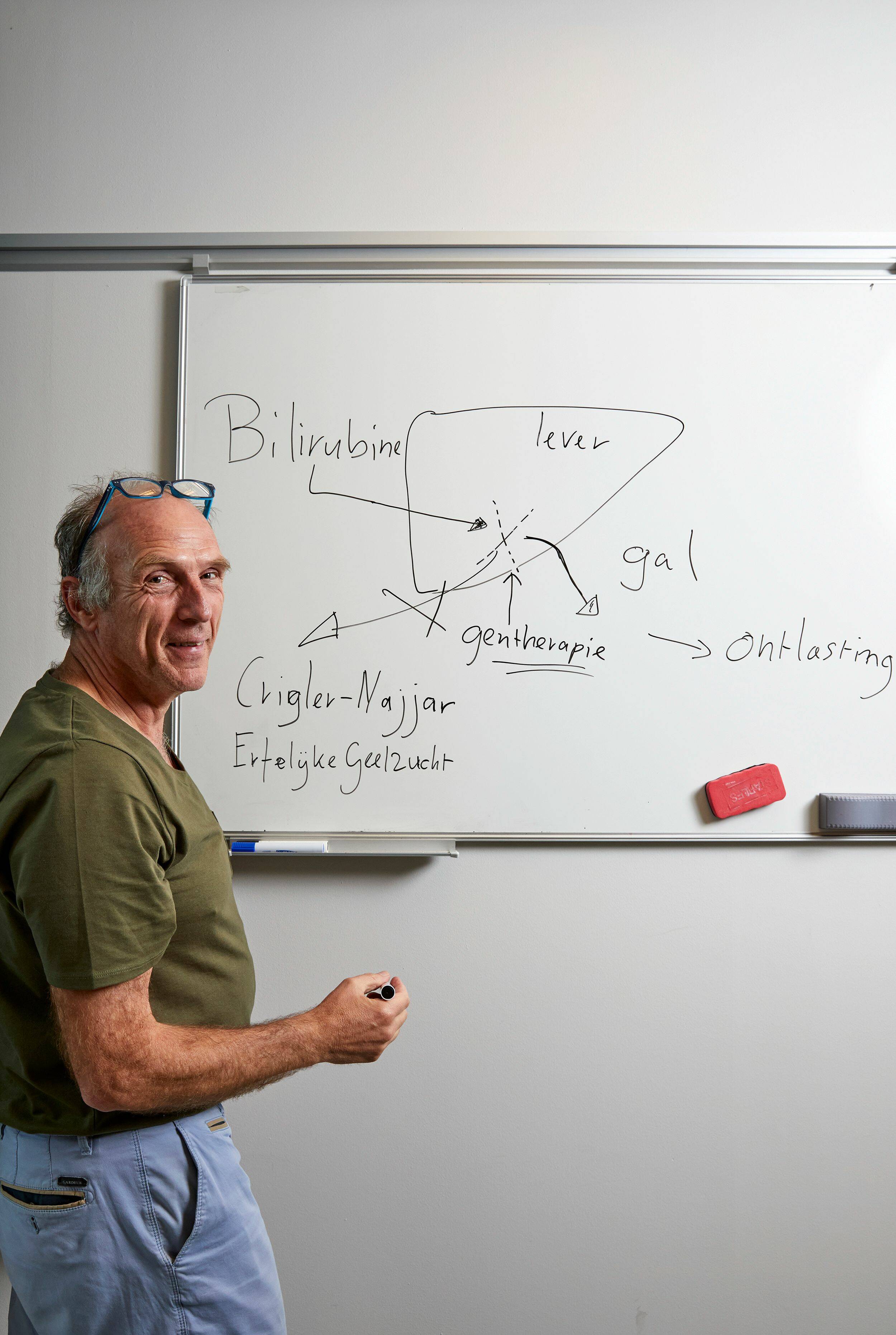
Die behandeling bestaat er vervolgens uit dat deze mensen lichttherapie krijgen. In de praktijk betekent dit dat ze de rest van hun leven onder een hoogtezon moeten slapen. Het blauwe licht uit die hoogtezon breekt namelijk ook bilirubine af. Maar in landen met minder goede medische zorg komt het vaak voor dat patiëntjes al jong overlijden aan de hersenschade door het opgehoopte bilirubine.” Het syndroom van Crigler-Najjar vererft autosomaal recessief. Dat betekent dat beide ouders een foute versie van het gen moeten doorgeven dat codeert voor het betrokken enzym.
30
jaar onderzoek naar de zeldzame ziekte Crigler-Najjar leidde uiteindelijk tot de eerste succesvol behandelde patiënten
Dertig jaar nadat het foute gen achter de zeldzame ziekte Crigler-Najjar in het AMC werd ontcijferd, publiceren de betrokken onderzoekers nu de resultaten van de eerste succesvol behandelde patiënten. “We hebben in die jaren vooral heel veel geleerd over hoe je gentherapie in een zieke levercel kunt brengen.”
Tekst: Rob Buiter • Foto: Mark Horn
e mag dit gerust een mijlpaal noemen, ja”, beaamt moleculair bioloog Piter Bosma van het Tytgat Instituut, het onderzoekscentrum voor lever- en darmziekten van Amsterdam UMC. Sinds hij in 1991 als postdoc begon met de zoektocht naar het gen dat verantwoordelijk is voor de erfelijke leverziekte Crigler-Najjar, is dit onderzoek als een rode draad door zijn carrière blijven lopen. Deze zomer werd al die noeste arbeid bekroond met een publicatie in het toonaangevende New England Journal of Medicine. “Samen met collega’s uit Italië, Duitsland en Frankrijk, publiceren we daarin de tussentijdse resultaten van de eerste vijf patiënten in de lopende klinische studie. Zeker voor de laatste drie van die patiënten, die de hoogste dosis van onze gentherapie kregen, was dat resultaat heel bemoedigend. Deze mensen hoeven al anderhalf jaar niet meer onder een hoogtezon te slapen, wat daarvoor een onmisbare behandeling was”, weet Bosma.
Hersenschade
Het syndroom van Crigler-Najjar is een zeldzame leveraandoening. In Nederland zijn ongeveer 25 patiënten met deze ziekte bekend. Deze mensen missen het enzym dat normaalgesproken in de lever bilirubine afbreekt en afvoert. Dat bilirubine is op zijn beurt weer een afbraakproduct van het zuurstofdragende hemoglobine in rode bloedcellen. Wordt dat bilirubine niet afgevoerd, dan kleuren de huid en het oogwit geel. En belangrijker nog: bilirubine wordt in de lever van mensen met het Crigler-Najjar-syndroom niet ontgift, waardoor het schade kan aanrichten aan de zenuwen. Zonder behandeling lopen patiënten dan ook ernstige en levensbedreigende hersenschade op. Bosma: “In landen met goede medische zorg wordt de ziekte meestal wel tijdig herkend en behandeld.
De zoektocht naar een oplossing begon voor Bosma dan ook in 1991 met het vinden en ontcijferen van dat ene foute gen. “Het was de tijd dat je nog niet zoals nu in een oogwenk de sequentie van een stuk DNA kon ontcijferen”, herinnert hij zich. “Maar nadat Amerikaanse collega’s de eerste puzzelstukjes al hadden gevonden, konden wij in 1992 de complete code publiceren, inclusief de mutaties die verantwoordelijk waren voor de ziekte.”
Gentherapie
Sinds de begindagen van de moleculaire genetica is gentherapie een van dé grote beloftes. Na het ontcijferen van de goede en de foute code, begon dan ook deel twee van de missie: hoe krijg je de goede code op de juiste plek, namelijk in de levercellen? “Voor zo’n gentherapie heb je een vector nodig”, legt Bosma uit. “Zeg maar: een Trojaans paard dat het goede gen de zieke cellen binnen kan smokkelen.”
Begin deze eeuw uitte Bosma zich bijzonder optimistisch in het toenmalige AMC-Magazine. Er was een virus gevonden, het Adeno Associated Virus, dat in staat leek om een gezonde versie van het gen in de levercellen te brengen. “Maar de vijf jaar die ik toen gokte, die we nodig zouden hebben voor een echte therapie, die waren toch wat te optimistisch ingeschat”, erkent hij zestien jaar na dato. “We dachten dat het mogelijk moest zijn om een compleet gen, dus met dubbelstrengs DNA in het virus te verpakken. Uiteindelijk was dat toch niet de weg en moesten we met een enkele streng werken.”

Nadat zogeheten ‘Gunn ratten’ met Crigler-Najjar – vernoemd naar hun ontdekker, dr. Charles Kenneth Gunn – succesvol waren behandeld met de experimentele gentherapie, troffen Bosma en collega’s nieuwe beren op de weg. “Om volwassen patiënten te behandelen, moesten we de productie van het virus met het goede gen flink opschalen, maar dat bleek niet eenvoudig. De kwaliteit was nogal wisselend, waardoor we niet eenvoudig toestemming kregen voor de experimenten. Logisch natuurlijk, maar ook vertragend.”
Klinische studie
De klinische studie kwam er uiteindelijk wel. De behandelaars in Amsterdam UMC, professor Ulrich Beuers en Sem Aronson, werkten daarvoor samen met onderzoekers en patiëntenverenigingen elders in Europa. Bosma: “Om te beginnen is het een zeer zeldzame ziekte. In vier landen vonden we in totaal vijftig potentieel geschikte kandidaten.
Die moesten we eerst screenen op een mogelijke afweerreactie tegen het virus dat we als Trojaans paard gebruikten. Je wilt natuurlijk niet dat de afweer het virus onschadelijk maakt vóór het de goede genen in de lever heeft gebracht. Vervolgens vielen er patiënten af die leverschade bleken te hebben, waardoor het virus minder goed de levercellen zou kunnen bereiken. En tot slot stonden niet alle potentieel geschikte kandidaten te springen. Zij wisten dat ze in zo’n vroeg stadium van het onderzoek een lagere dosis van het medicijn zouden krijgen dat weliswaar veiliger, maar mogelijk minder effectief zou zijn. En als dat niet succesvol zou zijn, dan zou hun lichaam afweer hebben opgebouwd tegen het gebruikte virus en zou er dus geen tweede poging in zitten.”
Bij de eerste twee patiënten verliep de behandeling met een lage dosis inderdaad matig succesvol. Bosma: “De dosering was afgesteld op de dosis van het virus die bij een gentherapie tegen hemofilie succesvol was gebleken. De bilirubine in hun bloed nam na een infuus met onze gentherapie inderdaad sterk af, maar steeg daarna ook weer snel naar de oude, ziekelijke niveaus.”
De volgende drie patiënten hadden een betere uitkomst van de behandeling, vertelt Bosma. “Deze mensen hoeven na een infuus met een hogere dosis gentherapie al meer dan een jaar geen lichttherapie meer te ondergaan. Weliswaar gaf één van de patiënten aan teleurgesteld te zijn dat het geel in haar oogwit niet blijvend is verdwenen, maar al met al zijn de bilirubinewaardes in het bloed van deze laatste drie patiënten voldoende en vooralsnog blijvend gedaald tot veilige waarden.”
Nieuwe fase
Met de publicatie van deze bemoedigende resultaten is voor de onderzoekers dan ook een nieuwe fase aangebroken. Na de eerste vijf volwassen patiënten in cohorten één en twee, worden nu ook de eerste kinderen opgenomen in het derde cohort van de klinische studie. Bij Bosma overheerst vooral opluchting. “Het zou natuurlijk enorm teleurstellend zijn geweest, wanneer we na al die jaren geen perspectief hadden kunnen bieden. En we hebben ook enorm veel geleerd, vooral over de manieren waarop je gentherapie in de levercellen kan krijgen. Want dat is steeds de uitdaging: hoe krijg je gentherapie op de plaats van bestemming? Er bestaat ook al een werkzame gentherapie tegen erfelijke blindheid. Daar is het relatief eenvoudig om de vector op de plaats van bestemming, in het oog te krijgen. Maar bij weer een andere erfelijke ziekte, in de hersenen, blijkt de gebruikte vector zo’n sterke voorkeur te hebben voor levercellen, dat er serieuze bijwerkingen ontstaan van de gentherapie.”
Voor Bosma zelf nadert het moment dat hij het stokje zal gaan overdragen aan een opvolger, waarschijnlijk een clinicus uit het Tytgat Instituut. “Ik kan die opvolger alleen maar aanraden om goed contact te houden met de fundamentele wetenschappers”, zegt Bosma. “Gentherapie kent nog heel veel voetangels en klemmen, dus we moeten op alle mogelijke manieren blijven samenwerken om vooruit te komen.” •
“Gentherapie kent nog heel veel voetangels en klemmen, dus we moeten op alle mogelijke manieren blijven samenwerken om vooruit te komen.”


onder een lamp

Die behandeling bestaat er vervolgens uit dat deze mensen lichttherapie krijgen. In de praktijk betekent dit dat ze de rest van hun leven onder een hoogtezon moeten slapen. Het blauwe licht uit die hoogtezon breekt namelijk ook bilirubine af. Maar in landen met minder goede medische zorg komt het vaak voor dat patiëntjes al jong overlijden aan de hersenschade door het opgehoopte bilirubine.” Het syndroom van Crigler-Najjar vererft autosomaal recessief. Dat betekent dat beide ouders een foute versie van het gen moeten doorgeven dat codeert voor het betrokken enzym.
Nieuwe fase
Met de publicatie van deze bemoedigende resultaten is voor de onderzoekers dan ook een nieuwe fase aangebroken. Na de eerste vijf volwassen patiënten in cohorten één en twee, worden nu ook de eerste kinderen opgenomen in het derde cohort van de klinische studie. Bij Bosma overheerst vooral opluchting. “Het zou natuurlijk enorm teleurstellend zijn geweest, wanneer we na al die jaren geen perspectief hadden kunnen bieden. En we hebben ook enorm veel geleerd, vooral over de manieren waarop je gentherapie in de levercellen kan krijgen. Want dat is steeds de uitdaging: hoe krijg je gentherapie op de plaats van bestemming? Er bestaat ook al een werkzame gentherapie tegen erfelijke blindheid. Daar is het relatief eenvoudig om de vector op de plaats van bestemming, in het oog te krijgen. Maar bij weer een andere erfelijke ziekte, in de hersenen, blijkt de gebruikte vector zo’n sterke voorkeur te hebben voor levercellen, dat er serieuze bijwerkingen ontstaan van de gentherapie.”
Voor Bosma zelf nadert het moment dat hij het stokje zal gaan overdragen aan een opvolger, waarschijnlijk een clinicus uit het Tytgat Instituut. “Ik kan die opvolger alleen maar aanraden om goed contact te houden met de fundamentele wetenschappers”, zegt Bosma. “Gentherapie kent nog heel veel voetangels en klemmen, dus we moeten op alle mogelijke manieren blijven samenwerken om vooruit te komen.” •
Die moesten we eerst screenen op een mogelijke afweerreactie tegen het virus dat we als Trojaans paard gebruikten. Je wilt natuurlijk niet dat de afweer het virus onschadelijk maakt vóór het de goede genen in de lever heeft gebracht. Vervolgens vielen er patiënten af die leverschade bleken te hebben, waardoor het virus minder goed de levercellen zou kunnen bereiken. En tot slot stonden niet alle potentieel geschikte kandidaten te springen. Zij wisten dat ze in zo’n vroeg stadium van het onderzoek een lagere dosis van het medicijn zouden krijgen dat weliswaar veiliger, maar mogelijk minder effectief zou zijn. En als dat niet succesvol zou zijn, dan zou hun lichaam afweer hebben opgebouwd tegen het gebruikte virus en zou er dus geen tweede poging in zitten.”
Bij de eerste twee patiënten verliep de behandeling met een lage dosis inderdaad matig succesvol. Bosma: “De dosering was afgesteld op de dosis van het virus die bij een gentherapie tegen hemofilie succesvol was gebleken. De bilirubine in hun bloed nam na een infuus met onze gentherapie inderdaad sterk af, maar steeg daarna ook weer snel naar de oude, ziekelijke niveaus.”
De volgende drie patiënten hadden een betere uitkomst van de behandeling, vertelt Bosma. “Deze mensen hoeven na een infuus met een hogere dosis gentherapie al meer dan een jaar geen lichttherapie meer te ondergaan. Weliswaar gaf één van de patiënten aan teleurgesteld te zijn dat het geel in haar oogwit niet blijvend is verdwenen, maar al met al zijn de bilirubinewaardes in het bloed van deze laatste drie patiënten voldoende en vooralsnog blijvend gedaald tot veilige waarden.”
“Gentherapie kent nog heel veel voetangels en klemmen, dus we moeten op alle mogelijke manieren blijven samenwerken om vooruit te komen.”
Nadat zogeheten ‘Gunn ratten’ met Crigler-Najjar – vernoemd naar hun ontdekker, dr. Charles Kenneth Gunn – succesvol waren behandeld met de experimentele gentherapie, troffen Bosma en collega’s nieuwe beren op de weg. “Om volwassen patiënten te behandelen, moesten we de productie van het virus met het goede gen flink opschalen, maar dat bleek niet eenvoudig. De kwaliteit was nogal wisselend, waardoor we niet eenvoudig toestemming kregen voor de experimenten. Logisch natuurlijk, maar ook vertragend.”
Klinische studie
De klinische studie kwam er uiteindelijk wel. De behandelaars in Amsterdam UMC, professor Ulrich Beuers en Sem Aronson, werkten daarvoor samen met onderzoekers en patiëntenverenigingen elders in Europa. Bosma: “Om te beginnen is het een zeer zeldzame ziekte. In vier landen vonden we in totaal vijftig potentieel geschikte kandidaten.


30
jaar onderzoek naar de zeldzame ziekte Crigler-Najjar leidde uiteindelijk tot de eerste succesvol behandelde patiënten
De zoektocht naar een oplossing begon voor Bosma dan ook in 1991 met het vinden en ontcijferen van dat ene foute gen. “Het was de tijd dat je nog niet zoals nu in een oogwenk de sequentie van een stuk DNA kon ontcijferen”, herinnert hij zich. “Maar nadat Amerikaanse collega’s de eerste puzzelstukjes al hadden gevonden, konden wij in 1992 de complete code publiceren, inclusief de mutaties die verantwoordelijk waren voor de ziekte.”
Gentherapie
Sinds de begindagen van de moleculaire genetica is gentherapie een van dé grote beloftes. Na het ontcijferen van de goede en de foute code, begon dan ook deel twee van de missie: hoe krijg je de goede code op de juiste plek, namelijk in de levercellen? “Voor zo’n gentherapie heb je een vector nodig”, legt Bosma uit. “Zeg maar: een Trojaans paard dat het goede gen de zieke cellen binnen kan smokkelen.”
Begin deze eeuw uitte Bosma zich bijzonder optimistisch in het toenmalige AMC-Magazine. Er was een virus gevonden, het Adeno Associated Virus, dat in staat leek om een gezonde versie van het gen in de levercellen te brengen. “Maar de vijf jaar die ik toen gokte, die we nodig zouden hebben voor een echte therapie, die waren toch wat te optimistisch ingeschat”, erkent hij zestien jaar na dato. “We dachten dat het mogelijk moest zijn om een compleet gen, dus met dubbelstrengs DNA in het virus te verpakken. Uiteindelijk was dat toch niet de weg en moesten we met een enkele streng werken.”
e mag dit gerust een mijlpaal noemen, ja”, beaamt moleculair bioloog Piter Bosma van het Tytgat Instituut, het onderzoekscentrum voor lever- en darmziekten van Amsterdam UMC. Sinds hij in 1991 als postdoc begon met de zoektocht naar het gen dat verantwoordelijk is voor de erfelijke leverziekte Crigler-Najjar, is dit onderzoek als een rode draad door zijn carrière blijven lopen. Deze zomer werd al die noeste arbeid bekroond met een publicatie in het toonaangevende New England Journal of Medicine. “Samen met collega’s uit Italië, Duitsland en Frankrijk, publiceren we daarin de tussentijdse resultaten van de eerste vijf patiënten in de lopende klinische studie. Zeker voor de laatste drie van die patiënten, die de hoogste dosis van onze gentherapie kregen, was dat resultaat heel bemoedigend. Deze mensen hoeven al anderhalf jaar niet meer onder een hoogtezon te slapen, wat daarvoor een onmisbare behandeling was”, weet Bosma.
Hersenschade
Het syndroom van Crigler-Najjar is een zeldzame leveraandoening. In Nederland zijn ongeveer 25 patiënten met deze ziekte bekend. Deze mensen missen het enzym dat normaalgesproken in de lever bilirubine afbreekt en afvoert. Dat bilirubine is op zijn beurt weer een afbraakproduct van het zuurstofdragende hemoglobine in rode bloedcellen. Wordt dat bilirubine niet afgevoerd, dan kleuren de huid en het oogwit geel. En belangrijker nog: bilirubine wordt in de lever van mensen met het Crigler-Najjar-syndroom niet ontgift, waardoor het schade kan aanrichten aan de zenuwen. Zonder behandeling lopen patiënten dan ook ernstige en levensbedreigende hersenschade op. Bosma: “In landen met goede medische zorg wordt de ziekte meestal wel tijdig herkend en behandeld.
Dertig jaar nadat het foute gen achter de zeldzame ziekte Crigler-Najjar in het AMC werd ontcijferd, publiceren de betrokken onderzoekers nu de resultaten van de eerste succesvol behandelde patiënten. “We hebben in die jaren vooral heel veel geleerd over hoe je gentherapie in een zieke levercel kunt brengen.”


Tekst: Rob Buiter • Foto: Mark Horn
