


Om verkeerde associaties vóór te zijn, spreekt Bijlsma in het geval van zijn eigen onderzoek op het gebied van kankertherapie dan ook liever over ‘tumoroïden’. “In ons lab kweken we geen kopietjes van organen, maar van tumoren, uit de slokdarm, de alvleesklier en ook wel uit de dikke darm van patiënten met kanker. Op die tumoroïden laten we vervolgens verschillende medicijnen los, om te zien of die een effect hebben op de betreffende tumor van die ene patiënt.”
14
labs werken samen in het Organoid Center Amsterdam University Medical Centers.
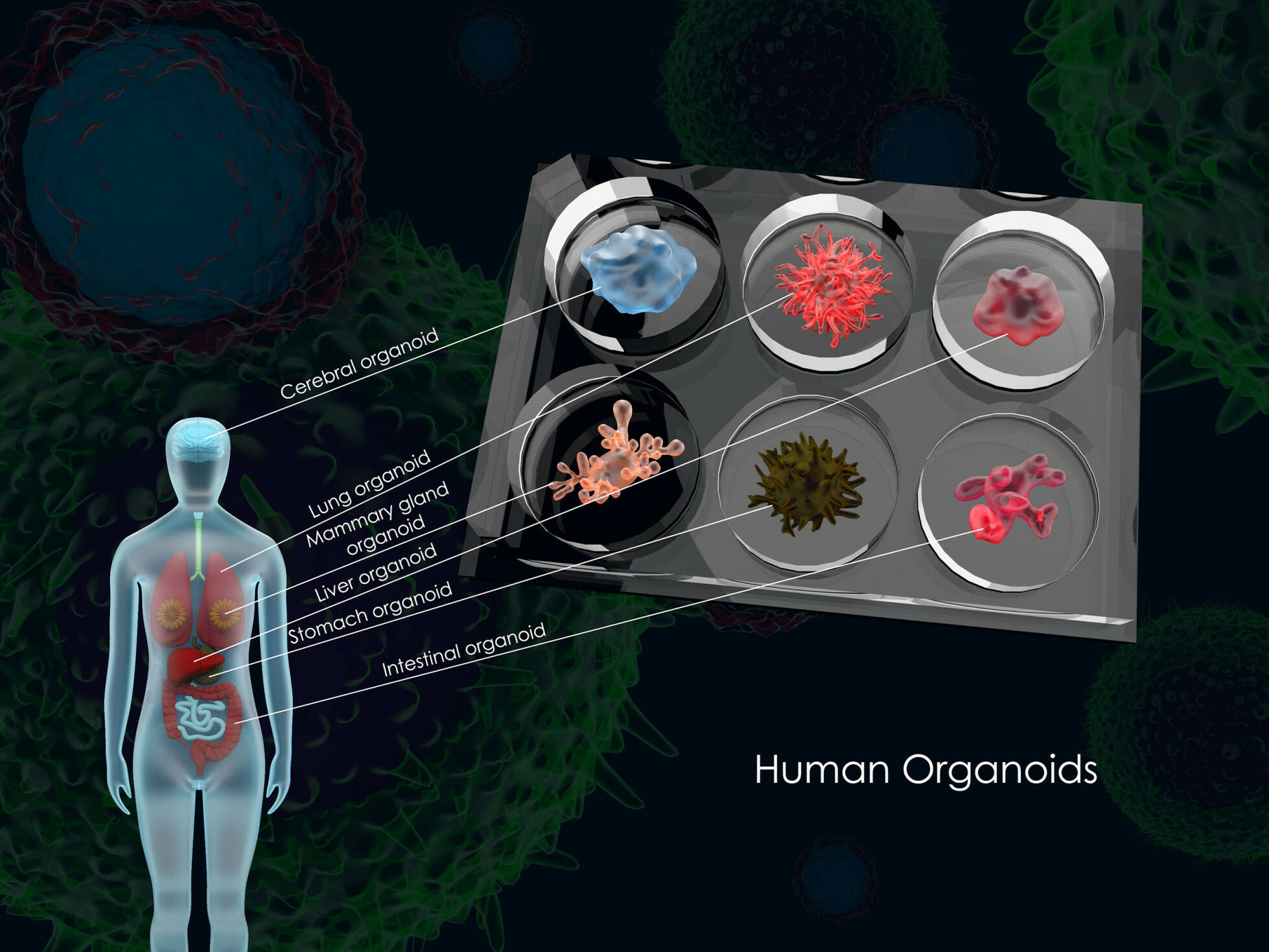
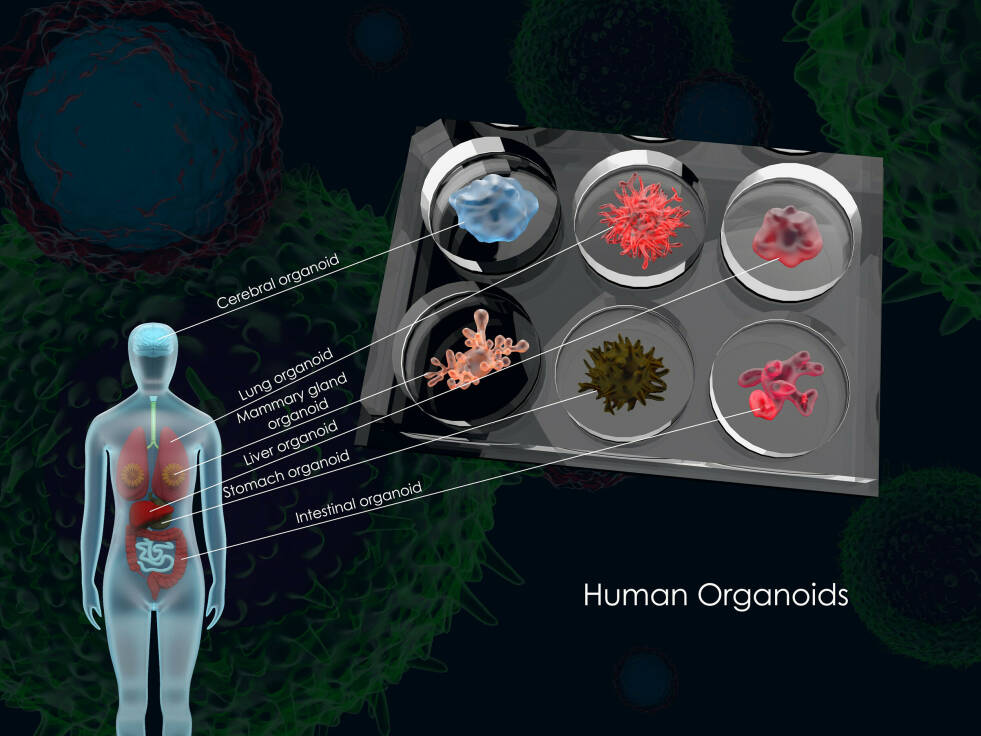
Organoïden zijn complexe, driedimensionale celkweken, die sinds enkele jaren een steeds belangrijkere plek krijgen in het medisch onderzoek. Om te voorkomen dat alle onderzoeksgroepen voor zich hetzelfde wiel uitvinden, heeft Amsterdam UMC nu een speciaal centrum opgericht om het werk aan organoïden te bundelen: het ORCAU.
Tekst: Rob Buiter • Foto: Mark Horn
rganoïden zijn helemaal hot and happening!” Maarten Bijlsma, onderzoeker in het laboratorium voor Experimentele Moleculaire Geneeskunde van Amsterdam UMC zegt het maar gewoon zoals het is. “Sinds geneticus Hans Clevers van het Utrechtse Hubrecht laboratorium een techniek beschreef om ‘mini-darmpjes’ in een reageerbuisje te kweken, zijn massa’s moleculair biologen met die techniek gaan experimenteren.”
“In essentie komt het hierop neer”, legt Bijlsma uit. “Stamcellen uit een bepaald orgaan, die dus nog veel verschillende kanten op kunnen groeien, stop je samen met de juiste voeding en de juiste ‘groeifactoren’ in een reageerbuis. Daar laat je die cellen groeien in een soort mal van bindweefsel. Dankzij die mal kunnen de cellen niet alleen als een plat laagje cellen over de bodem van de buis groeien, maar kunnen ze echt een driedimensionale, complexe structuur vormen, met verschillende essentiële eigenschappen van het orgaan waar de stamcellen uit zijn gehaald. En zo krijg je dus na verloop van tijd een soort orgaantje, een organoïde.”
Geen letterlijke kopie van echt orgaan
Zoals bij alles dat ‘hot and happening’ is, liggen hier ook misverstanden op de loer, waarschuwt Bijlsma. “Je moet je niet voorstellen dat zo’n organoïde letterlijk een minuscule kopie is van een echt orgaan. Als je bij wijze van spreken een stamcel van een hart gebruikt, ligt daar niet zomaar ineens een compleet hartje te kloppen onderin de reageerbuis. Een organoïde is en blijft in essentie een celkweek, zoals we die al lang kennen in de biologie”. Om daar direct aan toe te voegen: “Wel een heel complexe en veelbelovende soort celkweek!”
Want dat is een van de grote beloften van deze techniek: de mogelijkheid om relatief snel en vooral héél specifiek te kijken of een bepaald medicijn iets doet tegen een tumor van een specifieke patiënt.
Alvorens de organoïden of tumoroïden in de verre toekomst op die manier in de kliniek toegepast gaan worden, zijn ze nú al bruikbaar in het laboratorium, benadrukt Bijlsma. “Ze sparen daar al letterlijk de levens van proefdieren. Vroeg of laten moeten potentiële nieuwe medicijnen getest worden, eerst op proefdieren, later ook op patiënten. Dat is meestal natuurlijk terecht, maar in sommige gevallen is dat ook wel eens overdreven”, vindt hij. “Bij beoordelaars van wetenschappelijk onderzoek bestaat nog te vaak de traditionele reflex dat ze een resultaat eerst ‘in vivo’, dus in een levend organisme bevestigd willen zien, voor ze toestemming geven voor publicatie. In een deel van die gevallen kan een organoïde of een tumoroïde een prima vervanging zijn voor een proefdier.”
Maar ook daar blijkt nog wel een klein addertje onder het gras te zitten: een tumoroïde is van zichzelf ook niet honderd procent ‘proefdiervrij’. Bijlsma: “De mal die we nu nog gebruiken om de cellen in een driedimensionale structuur te laten groeien, komt ook weer uit het tumorweefsel van een proefdier. Maar daar levert één proefdier wel genoeg weefsel om een veelvoud aan malletjes te maken. Per saldo sparen tumoroïden dus wel degelijk de levens van enorm veel labmuizen”, aldus Bijlsma. “Er bestaan inmiddels ook al synthetische, honderd procent proefdiervrije mallen, maar die worden nog niet veel gebruikt, misschien omdat onderzoekers bang zijn om mogelijk essentiële factoren uit de biologische mallen te missen.”
Veertien labs werken samen in ORCAU
Het laboratorium voor Experimentele Moleculaire Geneeskunde is onlangs een samenwerking aangegaan met andere afdelingen binnen Amsterdam UMC die onderzoek doen met organoïden of tumoroïden. In het Organoid Center Amsterdam University Medical Centers, kortweg: ORCAU, werken nu al veertien labs samen. Bijlsma is enthousiast over dit samenwerkingsverband. “Zeker bij zo’n relatief nieuwe techniek bestaat de neiging dat iedereen voor zichzelf het wiel gaat zitten uitvinden, maar ondertussen ook allemaal in dezelfde valkuilen trapt. Dat voorkom je door ervaring te delen.”
Zelf leerde Bijlsma al van collega’s dat het niet zozeer draait om de snelheid waarmee je een stukje weefsel van een patiënt naar het lab brengt om dat te kweken, maar dat het vooral de kwaliteit is. “Het aantal tumorcellen in zo’n biopt, dat blijkt veel bepalender voor de kwaliteit van je uiteindelijke tumoroïde!”
Het is ook goed om de verwachtingen rond organoïden enigszins te temperen, vindt Bijlsma. “Deze nieuwe manier van celkweek geeft veel meer variatie in de cellen die je in je reageerbuis krijgt. Maar tegelijk is die zogeheten heterogeniteit ook wel beperkt. Ook deze complexe celkweken zijn nu niet ineens het alfa en omega van het kankeronderzoek.”
De onderzoeker hoopt dat de samenwerking niet bij de veertien huidige labs blijft. “Hoe meer ervaring we bundelen, hoe beter.” Wat dat betreft heeft Bijlsma ook nog wel specifieke wensen. “Sinds het eerste baanbrekende onderzoek van Clevers in het Hubrecht lab, werken we eigenlijk allemaal nog steeds met min of meer hetzelfde recept dat hij had bedacht voor het kweken van dunne darmweefsel. Dat blijkt in principe ook wel te voldoen voor het kweken van weefsels uit andere organen. Maar in de praktijk denk ik dat er nog veel verbetering mogelijk is, wanneer we ook specifieke recepten bedenken voor andere organen. Zo bestaat een alvleesklier uit kanaaltjes, of ‘ducten’ en uit ‘acinaire’ cellen, waar de enzymen voor de spijsvertering worden geproduceerd. Maar die acinaire cellen laten zich nog niet kweken; die groeien in de reageerbuis automatisch uit tot ducten. Voor het onderzoek naar alvleesklierkanker, dat een enorm slechte prognose heeft, zou het goed zijn als we daar ook een betere kweekmethode zouden kunnen ontwikkelen.” •
"Hoe meer ervaring we bundelen, hoe beter."



Om verkeerde associaties vóór te zijn, spreekt Bijlsma in het geval van zijn eigen onderzoek op het gebied van kankertherapie dan ook liever over ‘tumoroïden’. “In ons lab kweken we geen kopietjes van organen, maar van tumoren, uit de slokdarm, de alvleesklier en ook wel uit de dikke darm van patiënten met kanker. Op die tumoroïden laten we vervolgens verschillende medicijnen los, om te zien of die een effect hebben op de betreffende tumor van die ene patiënt.”
De onderzoeker hoopt dat de samenwerking niet bij de veertien huidige labs blijft. “Hoe meer ervaring we bundelen, hoe beter.” Wat dat betreft heeft Bijlsma ook nog wel specifieke wensen. “Sinds het eerste baanbrekende onderzoek van Clevers in het Hubrecht lab, werken we eigenlijk allemaal nog steeds met min of meer hetzelfde recept dat hij had bedacht voor het kweken van dunne darmweefsel. Dat blijkt in principe ook wel te voldoen voor het kweken van weefsels uit andere organen. Maar in de praktijk denk ik dat er nog veel verbetering mogelijk is, wanneer we ook specifieke recepten bedenken voor andere organen. Zo bestaat een alvleesklier uit kanaaltjes, of ‘ducten’ en uit ‘acinaire’ cellen, waar de enzymen voor de spijsvertering worden geproduceerd. Maar die acinaire cellen laten zich nog niet kweken; die groeien in de reageerbuis automatisch uit tot ducten. Voor het onderzoek naar alvleesklierkanker, dat een enorm slechte prognose heeft, zou het goed zijn als we daar ook een betere kweekmethode zouden kunnen ontwikkelen.” •
"Hoe meer ervaring we bundelen, hoe beter."
Veertien labs werken samen in ORCAU
Het laboratorium voor Experimentele Moleculaire Geneeskunde is onlangs een samenwerking aangegaan met andere afdelingen binnen Amsterdam UMC die onderzoek doen met organoïden of tumoroïden. In het Organoid Center Amsterdam University Medical Centers, kortweg: ORCAU, werken nu al veertien labs samen. Bijlsma is enthousiast over dit samenwerkingsverband. “Zeker bij zo’n relatief nieuwe techniek bestaat de neiging dat iedereen voor zichzelf het wiel gaat zitten uitvinden, maar ondertussen ook allemaal in dezelfde valkuilen trapt. Dat voorkom je door ervaring te delen.”
Zelf leerde Bijlsma al van collega’s dat het niet zozeer draait om de snelheid waarmee je een stukje weefsel van een patiënt naar het lab brengt om dat te kweken, maar dat het vooral de kwaliteit is. “Het aantal tumorcellen in zo’n biopt, dat blijkt veel bepalender voor de kwaliteit van je uiteindelijke tumoroïde!”
Het is ook goed om de verwachtingen rond organoïden enigszins te temperen, vindt Bijlsma. “Deze nieuwe manier van celkweek geeft veel meer variatie in de cellen die je in je reageerbuis krijgt. Maar tegelijk is die zogeheten heterogeniteit ook wel beperkt. Ook deze complexe celkweken zijn nu niet ineens het alfa en omega van het kankeronderzoek.”

14
labs werken samen in het Organoid Center Amsterdam University Medical Centers.
Want dat is een van de grote beloften van deze techniek: de mogelijkheid om relatief snel en vooral héél specifiek te kijken of een bepaald medicijn iets doet tegen een tumor van een specifieke patiënt.
Alvorens de organoïden of tumoroïden in de verre toekomst op die manier in de kliniek toegepast gaan worden, zijn ze nú al bruikbaar in het laboratorium, benadrukt Bijlsma. “Ze sparen daar al letterlijk de levens van proefdieren. Vroeg of laten moeten potentiële nieuwe medicijnen getest worden, eerst op proefdieren, later ook op patiënten. Dat is meestal natuurlijk terecht, maar in sommige gevallen is dat ook wel eens overdreven”, vindt hij. “Bij beoordelaars van wetenschappelijk onderzoek bestaat nog te vaak de traditionele reflex dat ze een resultaat eerst ‘in vivo’, dus in een levend organisme bevestigd willen zien, voor ze toestemming geven voor publicatie. In een deel van die gevallen kan een organoïde of een tumoroïde een prima vervanging zijn voor een proefdier.”
Maar ook daar blijkt nog wel een klein addertje onder het gras te zitten: een tumoroïde is van zichzelf ook niet honderd procent ‘proefdiervrij’. Bijlsma: “De mal die we nu nog gebruiken om de cellen in een driedimensionale structuur te laten groeien, komt ook weer uit het tumorweefsel van een proefdier. Maar daar levert één proefdier wel genoeg weefsel om een veelvoud aan malletjes te maken. Per saldo sparen tumoroïden dus wel degelijk de levens van enorm veel labmuizen”, aldus Bijlsma. “Er bestaan inmiddels ook al synthetische, honderd procent proefdiervrije mallen, maar die worden nog niet veel gebruikt, misschien omdat onderzoekers bang zijn om mogelijk essentiële factoren uit de biologische mallen te missen.”
rganoïden zijn helemaal hot and happening!” Maarten Bijlsma, onderzoeker in het laboratorium voor Experimentele Moleculaire Geneeskunde van Amsterdam UMC zegt het maar gewoon zoals het is. “Sinds geneticus Hans Clevers van het Utrechtse Hubrecht laboratorium een techniek beschreef om ‘mini-darmpjes’ in een reageerbuisje te kweken, zijn massa’s moleculair biologen met die techniek gaan experimenteren.”
“In essentie komt het hierop neer”, legt Bijlsma uit. “Stamcellen uit een bepaald orgaan, die dus nog veel verschillende kanten op kunnen groeien, stop je samen met de juiste voeding en de juiste ‘groeifactoren’ in een reageerbuis. Daar laat je die cellen groeien in een soort mal van bindweefsel. Dankzij die mal kunnen de cellen niet alleen als een plat laagje cellen over de bodem van de buis groeien, maar kunnen ze echt een driedimensionale, complexe structuur vormen, met verschillende essentiële eigenschappen van het orgaan waar de stamcellen uit zijn gehaald. En zo krijg je dus na verloop van tijd een soort orgaantje, een organoïde.”
Geen letterlijke kopie van echt orgaan
Zoals bij alles dat ‘hot and happening’ is, liggen hier ook misverstanden op de loer, waarschuwt Bijlsma. “Je moet je niet voorstellen dat zo’n organoïde letterlijk een minuscule kopie is van een echt orgaan. Als je bij wijze van spreken een stamcel van een hart gebruikt, ligt daar niet zomaar ineens een compleet hartje te kloppen onderin de reageerbuis. Een organoïde is en blijft in essentie een celkweek, zoals we die al lang kennen in de biologie”. Om daar direct aan toe te voegen: “Wel een heel complexe en veelbelovende soort celkweek!”
Organoïden zijn complexe, driedimensionale celkweken, die sinds enkele jaren een steeds belangrijkere plek krijgen in het medisch onderzoek. Om te voorkomen dat alle onderzoeksgroepen voor zich hetzelfde wiel uitvinden, heeft Amsterdam UMC nu een speciaal centrum opgericht om het werk aan organoïden te bundelen: het ORCAU.


Tekst: Rob Buiter • Foto: Mark Horn
